Veevaのクラウドベースのコンテンツ管理アプリケーションは、研究開発および臨床試験から、品質管理および製造まで、グローバルなライフサイエンス業界向けに特化し、開発されています。クラウド上のコンテンツ管理がいかにスムーズに行えるか、是非ご覧下さい。ご不明な点があれば、当社までお問い合わせください。
Veeva Vault QualityDocs
一貫した追跡記録、広範囲のアクセス、画期的なユーザビリティ
Vault QualityDocsにより、作成からレビュー、承認などのさまざまなGxP(適正×基準)のライフサイクル全般を通じて、企業チームがシンプルかつ安全に管理対象の文書を管理できます。是非ご確認下さい。
Veeva Vault Registrations
グローバルでの可視性、データ品質の向上、より良い情報に基づく意思決定
Vault Registrationsは、製品の申請登録と医療当局のコミットメントにおける計画、追跡、レポートをグローバルで一括管理できます。改善された可視性とデータ品質が、どのように規制業務を効率化できるのか、是非ご覧ください。
Veeva Vault Submissions
迅速な申請、連携の緊密化、継続的な可視性
Vault Submissionsを活用することで、申請コンテンツの作成と追跡を簡単に実現し、パワフルなビジネスレポートを容易に作成できるようになります。また開発から承認までのプロセス全体を通じた連携をよりシンプルにすることができます。
Veeva Development Cloud
Veeva Development Cloudで、臨床開発、薬事、品質にわたるのエンドツーエンドのビジネスプロセスをどのように推進し、製品ライフサイクル全体における効率化とコンプライアンスを向上させることができるのかをご覧ください。
Veeva Vault for Clinical Operations
臨床試験の実施を加速
臨床試験オペレーション向けVeeva VaultがVaultプラットフォームを活用して、CTMS、eTMF、スタディスタートアップにまたがるサイロを排除し、エンドツーエンドの臨床試験プロセスの合理化、臨床試験実施の加速、そしてリアルタイムの可視性を実現する方法をご覧ください。
Veeva Vault EDC
Veeva Vault EDCが、最新のインターフースとパーソナライズされたダッシュボード、そして簡単なナビゲーションを提供して正確なデータ入力をサポートし、臨床試験プロセスを合理化する方法をご覧ください。
Veeva Vault CTMS
臨床試験業務をより早く高品質に
Vault CTMSは、臨床試験業務を統合してプロセスを効率化し、臨床試験ポートフォリオ全体の完全な可視化を実現することにより、ライフサイエンス企業の臨床試験業務を容易にします。
Vault EDCとVault CTMSの統合
Vault EDCとVault CTMSをシームレスに統合して、どのように最新の登録情報を取得したり、モニタリング報告書のSDVデータを表示したりするのか、是非ご覧ください。
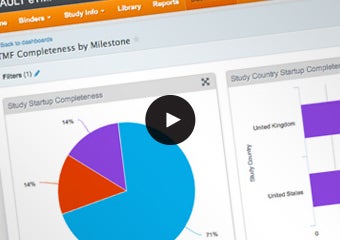
Veeva Vault eTMF
文書の収集、管理、および分析を合理化
スポンサーやCROが最新のクラウドベースの電子治験マスターファイル(Vault eTMF)のソリューションを活用することで、臨床試験を簡単に管理し、包括的なビジネスレポートを手間をかけずに作成可能です。是非ご確認ください。
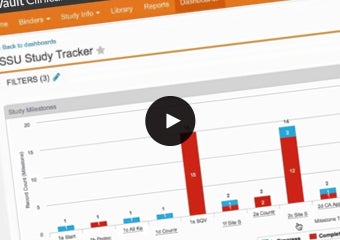
Veeva Vault Study Startup
治験立ち上げプロセスの時間短縮
Vault Study Startupにより、治験立ち上げの書類作成と活動を単一ソリューションで行い、治験立ち上げに関連する活動およびコンテンツに関する情報収集、追跡、管理を加速化します。
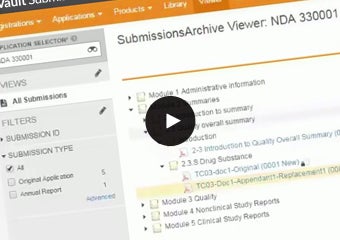
Veeva Vault Submissions Archive
Vault Submissions Archiveで承認申請履歴に安全にアクセス
どのようにVault Submissions Archiveが、安全に共有され、アーカイブされた申請書類と規制当局とのやりとりを世界中のどこからでも容易に表示させることを可能にするのか、是非ご覧ください。