RBQM 도입의 어려움을 극복하는 방법
지난 블로그 게시글에서는 미래의 하이브리드 임상시험을 위해 CRA 를 준비하는 위험요소-기반 모니터링 접근 방식의 도입에 관해 알아보았습니다. 이와 관련하여 본 블로그에서는 새로운 접근방식의 도입 시에 흔히 직면하는 어려움을 짚어보고 위험요소-기반 추진 계획의 내부 지원을 받기 위한 유용한 팁을 안내해 드리도록 하겠습니다.
위험요소-기반 품질 관리(RBQM, Risk-based quality management)는 새로운 개념이 아닙니다. 지난 2016년 11월에 발표된 ICH GCP E6(R2) 부록 섹션 5.0에서는 시험대상자의 보호와 임상시험 결과의 신뢰성 보장을 위해서 의뢰자는 임상시험의 품질경영을 위한 체계를 마련할 것을 권장하며, 다음과 같은 구성 요소와 함께 위험요소-기반 접근 방식을 제안하고 있습니다.
- 중요 절차 및 자료 확인
- 위험 확인
- 위험 평가
- 위험 관리
- 위험 의사소통
- 위험 검토
- 위험 보고
하지만 ACRO(Association of Clinical Research Organizations) 의 데이터에 따르면 업계 도입률은 예상보다 낮고, RBQM 의 모든 구성 요소를 포함한 연구가 적으며, 많은 기업이 구현 및 실행에 있어 단편적인 접근 방식을 취하고 있는 것으로 나타났습니다.1
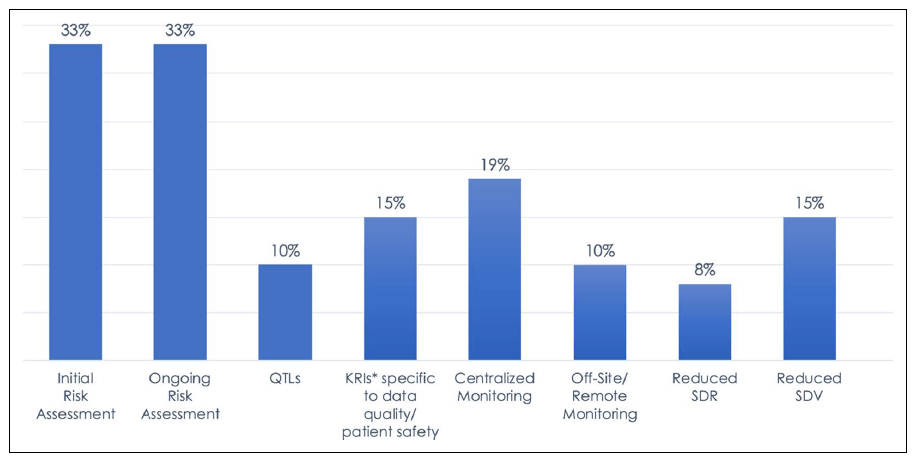
도표 1: 2019년 임상시험 RBM/RBQM 구성 요소 도입 현황 설문 조사에 포함된 총 6,513건의 임상시험의 데이터는 백분율로 표시 되어있습니다.
실태조사 요구사항을 충족하는 위험요소-기반 접근 방식을 도입하기 위해 스폰서가 정확히 무엇을 해야 하는지에 관하여 FDA 및 기타 규제 기관의 명확한 지침이 없고, 이로 인해 많은 기업들이 구현 및 도입에 어려움을 겪고 있습니다. 광범위한 RBQM 도입을 가로막는 또 다른 장벽은 다음과 같습니다.
- RBQM 기술에 투자할 예산 부족
- RBQM 을 통해 성공할 수 있는 기술과 지식에 대한 리소스 부족
- 조직의 새로운 모니터링 접근 방식 변경 및 도입 기피 현상
- 임상시험의 복잡성으로 인해 워크플로우와 부서 간 의견 조율에 영향을 줌으로써 RBQM 프로그램 진행을 저해
- RBQM 추진 계획을 실패했던 과거의 경험
기업이 위험을 사전에 완화하고 데이터 품질을 향상시킬 수 있는 가능성을 완전히 실현하기 위해서는 전체적인 관점에서 모든 측면의 RBQM 을 구현해야 합니다. 성공적인 RBQM 도입을 위한 방법을 조직에 안내할 수 있는 몇 가지 팁은 다음과 같습니다.
- 조직의 변화를 주도할 수 있도록 경영진의 지원을 확보합니다. 비용 및 노력을 타당화하는 비즈니스 사례를 구축하면 의사 결정권자는 추진 계획의 가치를 파악하고 이를 통해 임상시험 품질, 환자 안전 및 연구 효율성에 긍정적인 영향을 미칠 수 있는 방법을 이해할 수 있습니다.
- 조직에 올바른 프로세스와 기술을 적극적으로 전파합니다. 기술이 중단된 프로세스를 지원하지 않도록 최적화 영역을 파악합니다. 조직의 부서 간 구조에 의해 국한되지 않는 전체론적인 관점으로 프로세스를 평가합니다.
- 부서 간 합의를 이끌어내고 이해관계자를 대상으로 역할과 책임에 대한 교육을 실시합니다. RBQM 을 성공적으로 도입하려면 CRA 및 임상 운영 책임자뿐 아니라 임상 데이터 관리, 약물 감시, 데이터 통계 등 다른 부서와의 조율과 협력이 반드시 필요합니다. 이러한 모든 이해관계자들이 기대치를 제대로 올바르게 이해하고 있어야 포괄적인 RBQM 프로그램 내에서 위험 평가 템플릿, 핵심 위험 지표(KRI), 품질 허용 한계(QTL), 모니터링 계획, 보고 및 기타 구성 요소를 개발하는 데 그들의 전문성과 지식을 활용할 수 있습니다.
- 프로그램 진행 상황과 성공 수준을 가늠하기 위한 기준 지표(baseline metrics)를 정립합니다. 조직에서는 효율성을 평가하기 위해 데이터 품질 및 효율성과 같은 주요 영역의 진행 상황을 검토해야 합니다. 예를 들어, 근거 데이터 검토(SDR) 및 근거 데이터 검증(SDV) 시 감소가 발생했을 때 프로토콜 위반과 오딧 지적사항의 수를 추적하면 중앙 집중식 원격 모니터링으로 전환하는 것이 품질 및 환자 안전에 중대한 영향을 미치는지 여부를 조직에서 판단하는 데 도움이 될 수 있습니다.
COVID-19 팬데믹을 거치면서 우리 업계는 임상시험 품질과 환자의 안전을 감수하지 않고도 빠르게 변화에 적응하고 유연성을 유지할 수 있다는 교훈을 얻었습니다. 모니터링 효과에 영향을 주지 않고도 얼마든지 RBQM 으로 전환할 수 있습니다. 임상시험의 위험요소-기반 모니터링 및 품질 관리에 대해 더 알아보시려면 제가 ACRO 동료들과 공동으로 작성한 본 보고서를 확인해 보시기 바랍니다.
Veeva Vault CTMS 위험요소-기반 연구 관리를 중점적으로 다루는 본 블로그 시리즈의 마지막 연재도 기대해 주시기 바랍니다!
___________________________________
1. 임상시험의 위험요소-기반 모니터링: 과거, 현재 및 미래 ACRO 2021년 4월